细胞死亡是细胞生命现象的终结,对机体的生存、发展有着重要的作用。坏死 (necrosis) 和凋亡 (apoptosis) 是最常见的两种细胞死亡形式。随着细胞凋亡研究的不断深入,越来越多的现象已经无法用凋亡来解释。近些年,研究者陆续发现了其他细胞死亡方式,如细胞自噬 (autophagy)、坏死性凋亡 (necroptosis)、细胞焦亡 (pyroptosis)、铁死亡 (ferroptosis)等。其中,铁死亡是铁依赖性的、非细胞凋亡性的细胞死亡形式,以脂质活性氧 (ROS) 堆积为特点。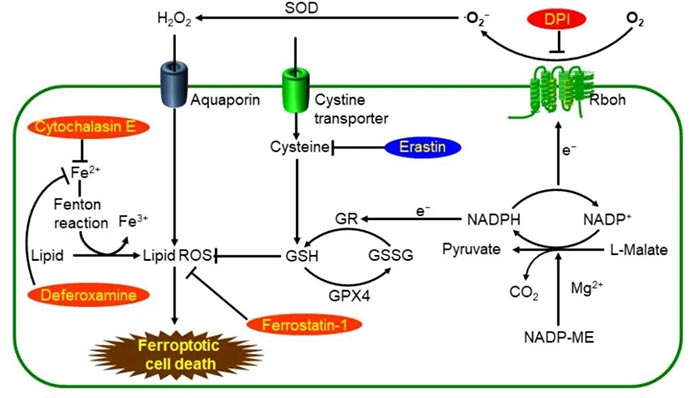
铁死亡成为近年来的研究热点,本文就铁死亡的发现、特点、发生机制及其与疾病的关系展开论述,将近年研究成果进行总结,期望为以铁死亡为基础的疾病治疗提供参考。
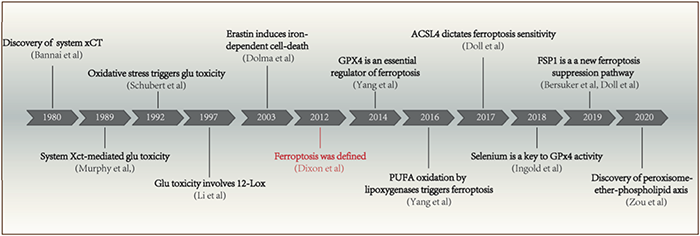
Dolma等于2003年发现了喜树碱(camptothecin,CPT)和一种新的化合物erastin,能够选择性致死表达RASV12蛋白的肿瘤细胞,但是其致死机制却不同:喜树碱诱导的细胞死亡会呈现出细胞核形态的改变、DNA片段化、出现活性胱天蛋白酶3 (caspase3),并且这个过程可以被caspase抑制剂所抑制;然而,erastin诱导的细胞死亡,却不能检测到上述现象,无细胞核形态变化、DNA片段化,以及caspase3的活化,并且这个过程不能被caspase抑制剂所逆转。因此erastin诱导的细胞死亡是一种新的死亡形式。随后Yang和Yagoda等发现这种死亡形式可以被铁螯合剂所抑制,且伴有细胞内活性氧的增多,同时发现了另一种可引起此种死亡形式的化合物——ras选择性致死化合物(ras-selective-lethal compound3,RSL3)。Dixon等根据其特点,于2012年正式将此种死亡形式命名为铁死亡:一种铁依赖性的,以细胞内活性氧堆积为特征的非细胞凋亡形式的细胞死亡。 当细胞胱氨酸运输蛋白受到抑制(如Erastin),胞内谷胱甘肽(GSH)会被耗尽,最终导致谷胱甘肽过氧化物酶(GPX4)的失活,导致脂质过氧化积累,达到一定程度即可诱发细胞死亡,GPX4酶受到抑制(如RSL3)也可以直接导致这一作用,铁离子螯合剂可以抑制这一过程。
铁死亡主要是细胞内脂质活性氧生成与降解的平衡失调所致。当细胞抗氧化能力降低,脂质活性氧堆积,就能引起细胞氧化性死亡,即铁死亡。铁死亡可以被多种化合物所诱导,虽然其发生的信号通路不同。但是上游通路最终都是通过直接或间接影响谷胱甘肽过氧化物酶 (glutathione peroxidase,GPXs) 的活性,降低细胞抗氧化能力,致使脂质过氧化反应增加,脂质活性氧增多,引起铁死亡的发生。
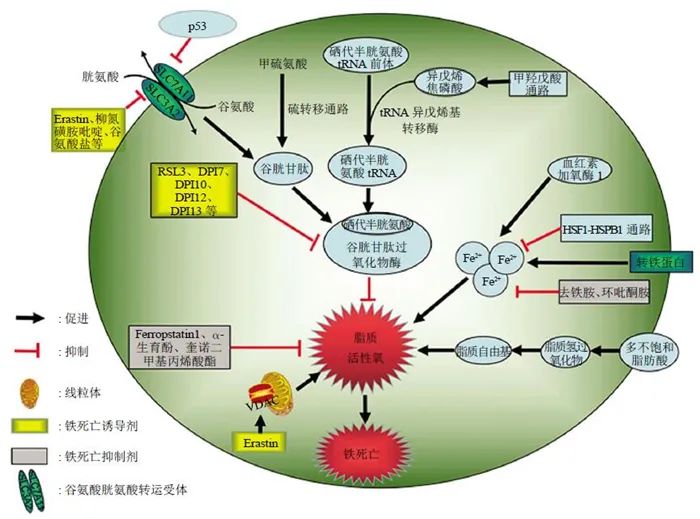
2.1 通过抑制胱氨酸谷氨酸转运受体(systemXC-)诱导铁死亡
Dixon等建立了器官型海马脑片培养模型 (OHSC),利用谷氨酸诱导可模拟出兴奋性毒性细胞死亡,并且这一过程也是氧化性的、铁依赖的过程,从而推断谷氨酸诱导的死亡与铁死亡可能共享同一条信号通路。已知谷氨酸诱导的细胞死亡可以通过两条通路启动,一条为钙离子的流入,一条为对依赖systemXC-的胱氨酸吸收通路的抑制。而钙离子的螯合剂,乙二醇双 (2-氨基乙基醚) 四乙酸对erastin诱导的铁死亡没有抑制作用。β巯基乙醇 (β-mercaptoethanol,β-ME) 能够在不通过systemXC-情况下促进胱氨酸的吸收,而它恰恰能够显著抑制erastin、谷氨酸诱导的细胞死亡。因此推断出systemXC-介导的胱氨酸吸收在铁死亡中有重要作用。systemXC-是由SLC7A11和SLC3A2组成的异二聚体。对systemXC-的抑制会导致SLC7A11的代偿性转录上调,而在erastin和柳氮磺胺吡啶诱导的铁死亡中,确实发现了SLC7A11的上调。 而抑制systemXC-,阻碍胱氨酸的吸收后,又通过怎样的路径导致铁死亡?Yang等发现谷胱甘肽 (glutathione,GSH) 的减少会导致GPXs活性降低。GPXs能够催化过氧化氢和氢过氧化物的降解,抑制脂质活性氧的生成,而谷胱甘肽是其必需的辅助因子。 综上,erastin通过抑制systemXC-,阻碍了谷胱甘肽的吸收,谷胱甘肽又是GPXs发挥作用的必要辅助因子,因此导致GPXs活性降低,细胞抗过氧化能力降低,脂质活性氧堆积,引起细胞的氧化性死亡。p53基因是重要的抑癌基因,其介导的细胞周期抑制、衰老、凋亡在肿瘤的发生发展过程中有重要作用。Jiang等用ROS处理p53基因沉默的H1299细胞,细胞活性没有变化,但激活p53基因后再用ROS处理,细胞死亡率高达90%,说明p53基因激活后细胞抗氧化能力显著降低。再向其加入铁死亡抑制剂ferrostatin-1后,细胞死亡率下降约40%,从而发现p53不仅可以引起细胞凋亡,也能诱导细胞铁死亡。Jiang等同时发现上调p53基因表达后,SLC7A11的信使RNA和蛋白表达量显著降低,从而证实SLC7A11为p53基因的新靶点。而systemXC-正是由SLC7A11和SLC3A2组成的异二聚体。因此,p53可通过下调SLC7A11的表达从而抑制systemXC-吸收胱氨酸,致使胱氨酸依赖的谷胱甘肽过氧化物酶活性降低,细胞抗氧化能力降低,脂质活性氧升高,引起细胞铁死亡。GPXs家族有许多成员,包括GPX1~GPX8,其中GPX4在铁死亡中扮演着更加重要的角色。RSL3与erastin都是铁死亡诱导剂,两者均能引起脂质活性氧的上升,但erastin通过抑制systemXC-,阻碍胱氨酸吸收的方式,降低了谷胱甘肽的含量,RSL3则不同,其诱导BJeLR细胞发生死亡时,谷胱甘肽水平并未受影响。因此猜测RSL3可能通过不同的方式诱导铁死亡。用荧光素标记的RSL3处理BJeLR细胞后再进行筛选,发现GPX4是RSL3的靶蛋白。另外,其他的一些化合物,如DPI7、DPI10等,同样能够直接作用于GPX4。GPX4是脂质过氧化过程的抑制蛋白,它能够降解小分子过氧化物以及相对复杂的脂质过氧化物。Yang等采用siRNA干涉HT-1080细胞的GPX4表达,发现GPX4表达下降的细胞对铁死亡更敏感,而上调GPX4的表达,则会产生对铁死亡的耐受。综上,RSL3、DPI7和DPI10等,能够直接作用于GPX4,抑制其活性,致细胞抗氧化能力下降,脂质活性氧上升,最终引起铁死亡。此外,甲羟戊酸通路 (mevalonatepath,MVA通路) 可通过调节硒代半胱氨酸tRNA的成熟而作用于GPX4,引起细胞的铁死亡。硒代半胱氨酸是GPX4活性中心的氨基酸之一,而将其嵌入GPX4则需要特殊的转运体——硒代半胱氨酸tRNA。硒代半胱氨酸tRNA的成熟需要异戊烯基转移酶将异戊烯焦磷酸 (isopentenylpyrophosphate,IPP) 中的异戊烯基转移至硒代半胱氨酸tRNA前体,而IPP是MVA通路的产物。因此MVA通路可以通过下调IPP,进而影响硒代半胱氨酸tRNA的合成,进一步干涉GPX4的活性,引起铁死亡。电压依赖性阴离子通道 (voltage-dependentanionchannels,VDACs) 是转运离子和代谢产物的跨膜通道,Yagoda等发现erastin可作用于VDACs。用siRNA干预VDAC2或VDAC3表达后发现细胞对erastin引起的铁死亡产生耐性,但是过表达VDAC2和VDAC3并未提高细胞对erastin的敏感性,所以VDAC2和VDAC3是铁死亡的必要非充分条件。此外,erastin还可导致线粒体外膜通透性的改变。因此Yagoda认为erastin作用于VDACs,引起线粒体功能紊乱,氧化性物质释放,最终引起细胞氧化性死亡。除了上述铁死亡的主要发生机制外,铁死亡还可以受到其他通路的调节。在氧化应激状态下,甲硫氨酸可通过硫转移途径 (thesulphur-transferpathway) 转化为胱氨酸,合成谷胱甘肽,协助谷胱甘肽过氧化物酶抑制脂质活性氧生成,避免氧化性细胞损伤。因此硫转移途径可抑制铁死亡的发生;血红素加氧酶1 (hemeoxygenase-1,HO-1) 是细胞内铁的重要来源之一,Kwon等证实了其可以诱导脂质过氧化反应从而导致铁死亡的发生;转铁蛋白也是细胞内铁的来源之一,它亦参与了铁死亡的调节过程。无论是erastin还是RSL3诱导的铁死亡,均涉及到铁依赖性的脂质活性氧的堆积。但是脂质活性氧的确切来源尚不明确。细胞膜脂质的多不饱和脂肪酸 (polyunsaturatedfattyacids,PUFAs) 链能够经过一系列反应形成脂质活性氧。PUFAs经过酶促或非酶促的氧化反应,可形成脂质氢过氧化物。在铁存在的情况下,脂质氢过氧化物能形成有毒性的脂质自由基,如烷氧基自由基,造成细胞损伤。并且这些自由基能转移邻近PUFAs的质子,启动新一轮的脂质氧化反应并进一步传递氧化性损害。在erastin处理的肿瘤细胞及GPX4缺失的小鼠细胞中,脂质活性氧的堆积和PUFAs的减少,均可被小分子抗氧化剂ferropstatin-1所抑制从而阻断铁死亡的过程,因此,脂质活性氧介导的细胞损伤是铁死亡所必需的。铁是铁死亡过程的必要条件,各种铁螯合剂均能抑制细胞的铁死亡。转铁蛋白受体能够促进细胞外铁转移至细胞内,其编码基因TFRC的沉默能够抑制erastin引起的铁死亡。相反的,补充铁离子可以加速erastin诱导的铁死亡,其他二价金属离子却不起作用。这些结果更证明了铁死亡过程中铁的必要性。 但是铁离子在细胞铁死亡中的确切作用至今仍不明确。铁螯合剂限制铁死亡最有可能的解释是阻止了铁向氧化物传递电子,从而抑制活性氧的生成。亲脂性铁螯合剂能够穿过细胞膜并螯合游离铁,阻止铁催化脂质自由基的形成,抑制了PUFAs的降解。也有报道提出,铁螯合剂能够直接作用于含铁离子的酶,从而抑制脂质过氧化。其中脂氧合酶最有可能介导铁依赖性的脂质活性氧的形成,因为它能催化PUFAs的氧化,并且能直接被亲脂性铁螯合剂失活。其他铁依赖性的酶,如脯氨酸羟化酶1 (prolylhydroxylases1,PHD1) ,也可能是铁螯合剂的靶点,但是其推动脂质活性氧生成的能力远不如脂氧合酶。 与亲脂性铁螯合剂不同,去铁胺 (deferoxamine,DFO) 是无膜通透性的铁螯合剂,能够通过细胞内吞作用堆积于细胞溶酶体。过氧化氢等致死性物质对细胞处理后会引起溶酶体的破坏,但erastin引起的铁死亡却未曾发现溶酶体的破坏。因此,DFO可能与溶酶体发生作用,截取溶酶体中本应转运至其他部位的铁离子,从而阻止脂质活性氧的生成。超微结构显示,铁死亡时细胞膜断裂和出泡,线粒体萎缩、线粒体脊减少甚至消失、膜密度增加、细胞核形态正常,但缺乏染色质凝集;电镜下观察到胞内线粒体变小、双层膜密度增高。
活性氧(ROS)增加、铁离子聚集,激活丝裂原活化蛋白激酶(MAPK)系统,通过降低胱氨酸的摄取、耗竭谷胱甘肽,抑制ystem Xc-和增加还原型酰腺嘌呤二核苷酸磷酸氧化酶,释放花生四烯酸等介质。(1)活性氧水平
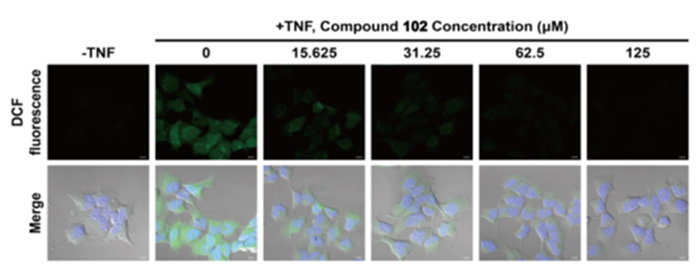
细胞内活性氧和脂质活性氧通过流式细胞术使用DCFH-DA和C11-BODIPY 荧光探针检测;
可以使用PGSK探针,流式细胞术或共聚焦显微镜检测细胞内铁含量的细胞膜透性染料;或者使用Iron Assay Kit检测细胞、组织中的铁水平;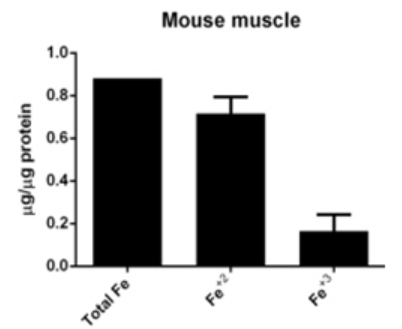
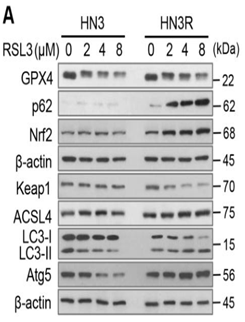
DAMPs(damage-associatedmolecular patterns molecules)释放前炎症介质(如高迁移率族蛋白B1等)。主要受核糖体蛋白L8(ribosomalprotein L8,RPL8),铁反应元件结合蛋白(ironresponse element binding protein 2,IREB2),ATP合成酶F0复合体亚基C3(ATP synthase F0 complex subunit C3,ATP5G3),三四肽重复结构域35(tetratricopeptide repeat domain 35,TTC35),柠檬酸合成酶(citratesynthase,CS),酰基辅酶A合成酶家族成员2(acyl-CoAsynthetase family member 2,ACSF2)以及受代谢、储存基因TFRC、ISCU、FTH1、FTL、SLC11A2的调节。检测与铁死亡相关的蛋白表达,如PTGS2、NOX1、FTH1、COX2、GPX4、ACSL4等,其中COX2、ACSL4、PTGS2、NOX1在铁死亡细胞中表达上调,GPX4、FTH1在铁死亡细胞中表达下调;
1. System Xc抑制剂,Erastin 及其类似物 sulfasalazine, glutamate, and sorafenib;
4. FINO2可间接抑制GPX4,诱导脂质过氧化
1. 结构特点
Position(s) | DescriptionActions | Length |
1 – 43 | Cytoplasmic | 43 |
44 – 64 | Helical | 21 |
65 – 74 | Extracellular | 10 |
75 – 95 | Helical | 21 |
96 – 113 | Cytoplasmic | 18 |
114 – 134 | Helical | 21 |
135 – 158 | Extracellular | 24 |
159 – 179 | Helical | 21 |
180 – 189 | Cytoplasmic | 10 |
190 – 210 | Helical | 21 |
211 – 234 | Extracellular | 24 |
235 – 255 | Helical | 21 |
256 – 265 | Cytoplasmic | 10 |
266 – 286 | Helical | 21 |
287 – 317 | Extracellular | 31 |
318 – 338 | Helical | 21 |
339 – 364 | Cytoplasmic | 26 |
365 – 385 | Helical | 21 |
386 – 387 | Extracellular | 2 |
388 – 408 | Helical | 21 |
409 – 422 | Cytoplasmic | 14 |
423 – 443 | Helical | 21 |
444 – 449 | Extracellular | 6 |
450 – 470 | Helical | 21 |
471 – 501 | Cytoplasmic | 31 |
2. 调控机制
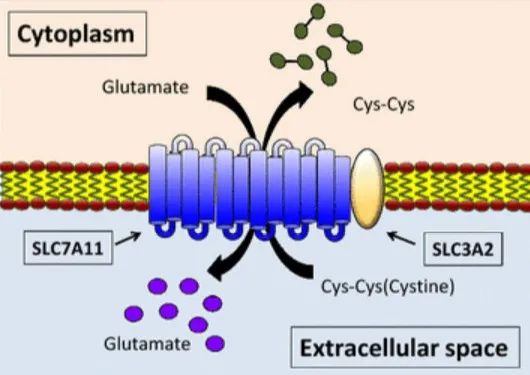
胱氨酸是一种非常重要的氨基酸,在蛋白质合成、翻译后修饰和氧化还原维持中具有多种作用。半胱氨酸是谷胱甘肽限速前体,谷胱甘肽是一种由三个氨基酸(半胱氨酸、谷氨酸和甘氨酸)组成的三肽,是细胞内最丰富的抗氧化剂。
胞内半胱氨酸可通过从头生物合成(通过转硫途径)或通过蛋白质降解回收,大多数癌细胞主要依靠胱氨酸转运蛋白系统 Xc-(由催化亚基SLC7A11伴侣亚基SLC3A2组成)从细胞外环境获得胱氨酸,然后通过消耗NADPH的还原反应在胞质中将其转化为半胱氨酸;半胱氨酸随后被用于合成谷胱甘肽(以及其他生物分子)。越来越多的研究表明,SLC7A11介导的胱氨酸摄取在抑制氧化反应和维持氧化应激条件下的细胞存活中发挥关键作用。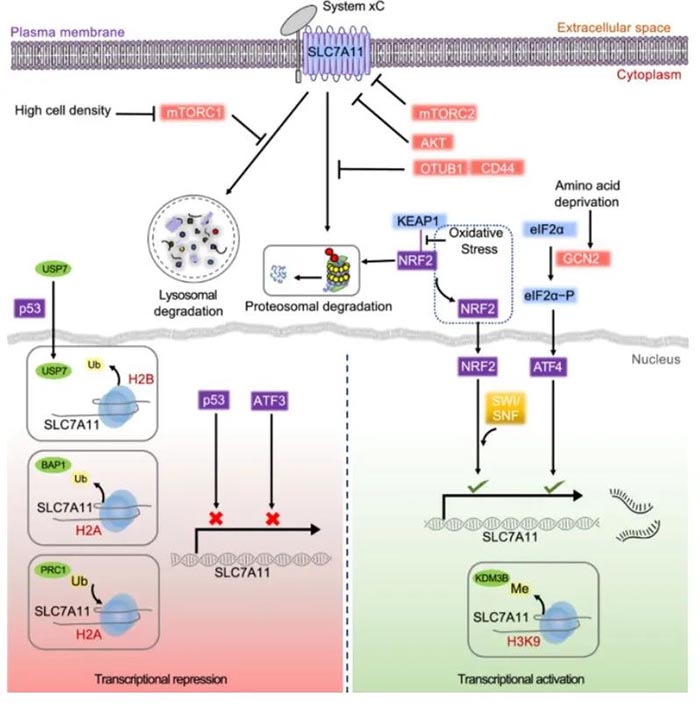
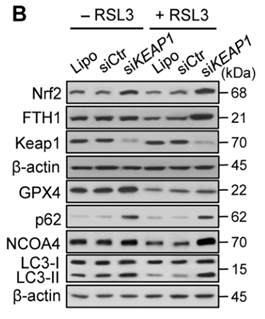
已知SLC7A11的表达可以在多种应激条件下被诱导,包括氧化应激,氨基酸饥饿,代谢应激和遗传毒性应激,可能是一种适应性反应,使细胞能够在应激条件下恢复氧化还原稳态并维持存活。激活转录因子4(ATF4)和/或核因子红系相关因子2(NRF2)是调控压力诱导的SLC7A11表达的两个主要转录因子。此外,p53可抑制SLC7A11的转录,从而调节铁死亡,在肿瘤抑制中起关键作用。而ATF3也可以与SLC7A11启动子结合并抑制其表达。 BAP1是一种核去泛素酶(DUB),癌细胞中BAP1缺乏会导致SLC7A11上调和铁死亡抵抗。值得注意的是,SLC7A11不仅可以通过mTORC1进行调控,还可以通过mTORC2进行磷酸化调控。其他研究还表明,SLC7A11的细胞表面定位也受到调节,如EGF受体(EGFR)与SLC7A11相互作用并在质膜上维持其适当的定位。
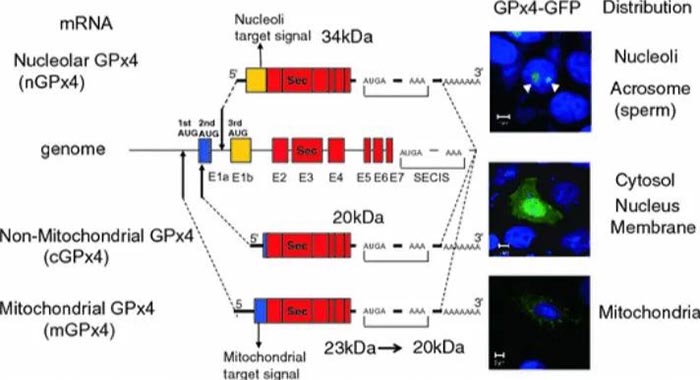
1-27位氨基酸:线粒体靶向序列
73位氨基酸:U → A: Loss of enzyme activity.
73位氨基酸:U → C: Almost complete loss of enzyme activity.
2. 蛋白翻译后修饰
蛋白水平上的修饰也是维持GPX4蛋白稳定的调控方式。热休克蛋白A5(HSPA5)也称GRP78或BIP,是分子伴侣蛋白,主要在内质网上表达。HSPA5是未折叠蛋白反应的重要组成部分,在内质网应激条件下,促进细胞存活。ZHU等发现,HSPA5能够与GPX4相互作用,抑制其泛素化降解,而延长其半衰期。遗憾的是,HSPA5究竟与GPX4的哪种E3泛素连接酶竞争结合位点,尚未发现。自噬是细胞对环境变化的有效反应,GPX4蛋白水平也能被自噬直接调控。在GPX4的氨基酸序列内有一种酪氨酸被认为是磷酸化的,但其在控制酶活性中的作用尚不清楚。翻译后调控可能将GPX4的水平和活性维持在既能预防过氧化,也能不影响重要的生理脂质信号分子的产生。
FSP1的N端存在经典的豆蔻酰化修饰的基序,而该基序的存在说明FSP1可能与脂质双分子存在相互联系。通过FSP1在脂滴以及脂膜的定位,发现了FSP1存在豆蔻酰化的修饰。而且,通过对FSP1中豆蔻酰化修饰位点的突变进一步证明了FSP1只有被豆蔻酰化修饰后才能够起到抗铁死亡的功能。 那么,FSP1是如何抑制铁死亡的呢?通过前人的研究,AIF家族被发现具有辅酶Q(CoQ10)氧化还原酶的活性。在FSP1过表达的情况下,铁死亡被抑制,但是CoQ10同时缺陷时候,细胞抑制铁死亡的能力消失。进一步地发现FSP1通过还原CoQ10来阻止脂质氧化进而抑制铁死亡。
铁死亡在有关肿瘤的研究中成为近几年的热点之一。通过提高erastin衍生物的溶解度、分离度以及效价,其中的某些衍生物在异种移植肿瘤中已经初见成效。纳米颗粒诱导铁死亡也在异种移植研究中得到了证实。肿瘤抑癌基因p53能抑制 SLC7A11(systemXC-的组成部分),在某些情况下也能够诱导铁死亡的发生;核转录因子Nrf2能抑制肝细胞癌中铁死亡的发生;抑制Nrf2的表达能增强细胞铁死亡。
最近研究证明,铁死亡很有可能是引起PD神经退行性变细胞死亡的通路之一,铁是治疗PD的有效靶点。在细胞和MPTP诱导的PD小鼠模型中运用铁螯合剂(去铁酮),能减少氧化应激,增强多巴胺可利用性,从而改善现有的运动症状和减少运动功能的退化。早期阶段的PD患者中,应用去铁酮治疗可减缓运动缺陷的进展,减少现有的运动症状。在MPTP治疗前24小时给小鼠注射铁死亡抑制剂ferrostatin-1可显著挽救行为障碍和神经元丢失,这表明常见的PD毒素在动物模型中引起神经退行性变的机制可能是铁死亡。
基础研究中经常涉及到对多种细胞死亡方式的研究,如细胞自噬、凋亡、焦亡等。细胞铁死亡是最近几年才被发现的一种细胞死亡方式,目前对它的形态学、生物学、机制通路有了部分了解,但铁死亡过程涉及多种机制,受到信号通路的精密调控,铁死亡与疾病的发生有何种联系,是否与其他细胞死亡方式联合介导疾病的进展,因此,进一步深入研究铁死亡的作用机理,研究其在不同疾病类型中的作用,对寻找相关疾病的治疗靶点、靶向药物的研发具有重要意义。
参考文献
1. Dixon, S.J., et al., Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell, 2012. 149(5): p. 1060-72.
2. Yang, W.S. and B.R. Stockwell, Synthetic lethal screening identifies compounds activating iron-dependent, nonapoptotic cell death in oncogenic-RAS-harboring cancer cells. Chem Biol, 2008. 15(3): p. 234-45.
3. Yagoda, N., et al., RAS-RAF-MEK-dependent oxidative cell death involving voltage-dependent anion channels. Nature, 2007. 447(7146): p. 864-8.
4. Stockwell, B.R., et al., Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease. Cell, 2017. 171(2): p. 273-285.
5. Bersuker, K., et al., The CoQ oxidoreductase FSP1 acts parallel to GPX4 to inhibit ferroptosis. Nature, 2019.
6. Doll, S., et al., FSP1 is a glutathione-independent ferroptosis suppressor. Nature, 2019.

























